Биологическое воздействие
Как и в литосфере, в организме человека кремний – один из топовых макроэлементов (до 4%).
О нехватке вещества сигнализирует следующие факторы:
- Тусклость, ломкость волос, ногтей.
- Сухость кожи.
- Частые ОРВИ, ОРЗ.
- Учащенное сердцебиение.
- Ослабленность скелета (позвоночные боли, остеопороз).
- Бесплодие.
Плюс пониженный иммунитет. У детей – замедление роста и общего развития.
Пополнить запас микроэлемента помогают продукты.
Больше всего вещества в продуктах, богатых клетчаткой:
- Необработанные крупы: рис, овес, ячмень, гречка.
- Все бобовые.
- Орехи, овощи, ягоды, фрукты,
В «животном» сегменте это мясо, яйца, морепродукты, молоко.
Описание
Кремний представляет собой четырехкоординированный атом, который обычно тетраэдрически связаны с четырьмя соседними атомами кремния. В кристаллическом кремнии (c-Si) эта тетраэдрическая структура продолжается в большом диапазоне, образуя, таким образом, хорошо упорядоченную кристаллическую решетку.
В аморфном кремнии этого дальнего порядка нет. Скорее атомы образуют непрерывную случайную сеть. Более того, не все атомы в аморфном кремнии четырехкоординированы. Из-за неупорядоченной природы материала некоторые атомы имеют болтающаяся облигация. Физически эти оборванные связи представляют собой дефекты в непрерывной случайной сети и могут вызывать аномальное электрическое поведение.
Материал может быть пассивирован водородом, который связывается с оборванными связями и может снизить плотность оборванных связей на несколько порядков. Гидрированный аморфный кремний (a-Si: H) имеет достаточно низкое количество дефектов для использования в таких устройствах, как солнечные батареи. фотоэлектрический клетки, особенно в протокристаллический режим роста. Однако гидрирование связано со световой деградацией материала, называемой Эффект Стаблера – Вронски.
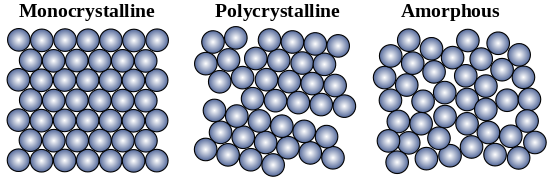 Схема аллотропных форм кремния: монокристаллический, поликристаллический, и аморфный кремний
Схема аллотропных форм кремния: монокристаллический, поликристаллический, и аморфный кремний
Структура и электронная конфигурация
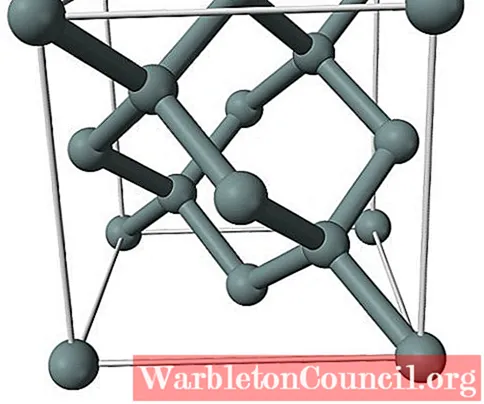
На изображении выше показана гранецентрированная кубическая структура (ГЦК), такая же, как у алмаза, для кристалла кремния. Серые сферы соответствуют атомам Si, которые, как видно, ковалентно связаны друг с другом; кроме того, они имеют тетраэдрическое окружение, воспроизводимое вдоль кристалла.
Кристалл кремния является ГЦК, потому что атом Si находится на каждой из граней куба (6 × 1/2). Точно так же есть восемь атомов Si в вершинах куба (8 × 1/8) и четыре, расположенных внутри него (те, которые показывают четко определенный тетраэдр вокруг них, 4 × 1).
При этом каждая элементарная ячейка содержит в общей сложности восемь атомов кремния (3 + 1 + 4, числа указаны в абзаце выше); характеристика, которая помогает объяснить его высокую твердость и жесткость, поскольку чистый кремний представляет собой ковалентный кристалл, подобный алмазу.
Области применения
Сферы использования панелей из аморфного кремния диктуется их главными достоинствами. Наиболее часто пленки A-Si рекомендуются к применению в следующих случаях:
- значительной загазованности и/или запыленности воздуха;
- преобладания неблагоприятных погодных условий, прежде всего частой облачности и осадков;
- высоких среднегодовых температур окружающей среды;
- сложности или инженерная нецелесообразность установки панелей в оптимальное положение относительно солнца;
- при стремлении использовать полупроводниковые элементы в качестве полупрозрачных стекол или пленки – довольно частое дизайнерское решение в современном мире.
Как основной источник энергии батареи из аморфного кремния пока малоэффективны. Однако в качестве альтернативного ее поставщика – особенно в паре с аккумуляторами – их применение встречается все чаще.
Где найти и получить

Кремний является седьмым по распространенности элементом во Вселенной и вторым в земной коре, а также обогащает мантию Земли своим обширным семейством минералов. Этот элемент очень хорошо связывается с кислородом, образуя широкий спектр оксидов; среди них кремнезем, SO2, силикаты (разнообразного химического состава).
Кремнезем можно увидеть невооруженным глазом в пустынях и на пляжах, поскольку песок в основном состоит из SiO.2. В свою очередь, этот оксид может проявляться в нескольких полиморфах, наиболее распространенными из которых являются: кварц, аметист, агат, кристобалит, триполи, коэсит, стишовит и тридимит. Кроме того, его можно найти в аморфных твердых телах, таких как опалы и диатомовая земля.
Между тем силикаты еще богаче структурно и химически. Некоторые силикатные минералы включают: асбест (белый, коричневый и голубоватый), полевой шпат, глины, слюды, оливины, алюмосиликаты, цеолиты, амфиболы и пироксены.
Практически все породы состоят из кремния и кислорода с их стабильными связями Si-O, а также их кремнеземов и силикатов, смешанных с оксидами металлов и неорганическими частицами.
ПРОИСХОЖДЕНИЕ
 Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л. Отмечены единичные факты нахождения чистого кремния в самородном виде – мельчайшие включения (наноиндивиды) в ийолитах Горячегорского щелочно-габброидного массива (Кузнецкий Алатау, Красноярский край); в Карелии и на Кольском п-ове (по мат. изучения Кольской сверхглубокой скважины); микроскопические кристаллы в фумаролах вулканов Толбачик и Кудрявый (Камчатка).
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л. Отмечены единичные факты нахождения чистого кремния в самородном виде – мельчайшие включения (наноиндивиды) в ийолитах Горячегорского щелочно-габброидного массива (Кузнецкий Алатау, Красноярский край); в Карелии и на Кольском п-ове (по мат. изучения Кольской сверхглубокой скважины); микроскопические кристаллы в фумаролах вулканов Толбачик и Кудрявый (Камчатка).
Описание
Кремний представляет собой четырехкоординированный атом, который обычно тетраэдрически связаны с четырьмя соседними атомами кремния. В кристаллическом кремнии (c-Si) эта тетраэдрическая структура продолжается в большом диапазоне, образуя, таким образом, хорошо упорядоченную кристаллическую решетку.
В аморфном кремнии этого дальнего порядка нет. Скорее атомы образуют непрерывную случайную сеть. Более того, не все атомы в аморфном кремнии четырехкоординированы. Из-за неупорядоченной природы материала некоторые атомы имеют болтающаяся облигация. Физически эти оборванные связи представляют собой дефекты в непрерывной случайной сети и могут вызывать аномальное электрическое поведение.
Материал может быть пассивирован водородом, который связывается с оборванными связями и может снизить плотность оборванных связей на несколько порядков. Гидрированный аморфный кремний (a-Si: H) имеет достаточно низкое количество дефектов для использования в таких устройствах, как солнечные батареи. фотоэлектрический клетки, особенно в протокристаллический режим роста. Однако гидрирование связано со световой деградацией материала, называемой Эффект Стаблера – Вронски.
 Схема аллотропных форм кремния: монокристаллический, поликристаллический, и аморфный кремний
Схема аллотропных форм кремния: монокристаллический, поликристаллический, и аморфный кремний
Где используется
Применение кремния определяют свойства. Неметалл хрупок, поэтому непригоден в качестве «скелета» конструкций. Однако эта же характеристика позволяет идеально обрабатывать поверхность кристаллов, что ценят производители электроники.
 Применение кремния
Применение кремния Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
Промышленность
Кроме IT-индустрии неметалл востребован традиционными сегментами промышленности.

- Металлургия. Технический кремний используется как раскислитель при выплавке чугуна, упрочнитель сплавов.
- Машино-, приборостроение. Сплавы с металлами тверды, тугоплавки. Используются как компоненты турбин, термоэлементы оборудования металлургических комбинатов.
- Электро-, радиотехника. Из неметалла-полупроводника изготавливают фотоэлементы, интегральные схемы, транзисторы, диоды, другую продукцию.
- Органический, неорганический синтез.
- Прозрачность вещества для инфракрасного спектра – главный плюс для производителей оптики.
- Стекольная промышленность. Силикаты – исходник при производстве стекла, хрусталя, керамики, фарфоро-фаянсового ассортимента.
- Песок – компонент строительных материалов (цемента, бетона).
- Почти универсален карбид (кремний + углерод). Соединение закупают металлурги, приборостроители, химпром. Твердое (7 баллов по Моосу) вещество используется как полупроводник широкого диапазона действия и абразив.
- Кремнийорганические соединения закупают производители силиконовой продукции: герметиков, смазок, других изделий.
То есть применение нашлось чистому веществу и соединениям.
Другие сферы
Фармацевты используют кремниевые продукты как базис препаратов для профилактики и лечения атеросклероза, туберкулеза, артрита.
Эстетичные разновидности неметалла – агаты, аметисты, горный хрусталь, опалы, сердолик – закупают ювелиры и собиратели минералогических коллекций.
Физико-химические характеристики
Кремний – это неметалл, но выступает как восстановитель либо окислитель:
- Образует сплавы (силициды) с большинством металлов.
- В обычном микроклимате покрывается пленкой-оксидом, становясь инертным.
- Химическая активность почти нулевая, однако растет с ростом температуры.
- Физические и химические свойства формируются строением кристаллической решетки (аллотропным форматом). Например, аморфный неметалл активно впитывает влагу, быстрее взаимодействует при обычной температуре.
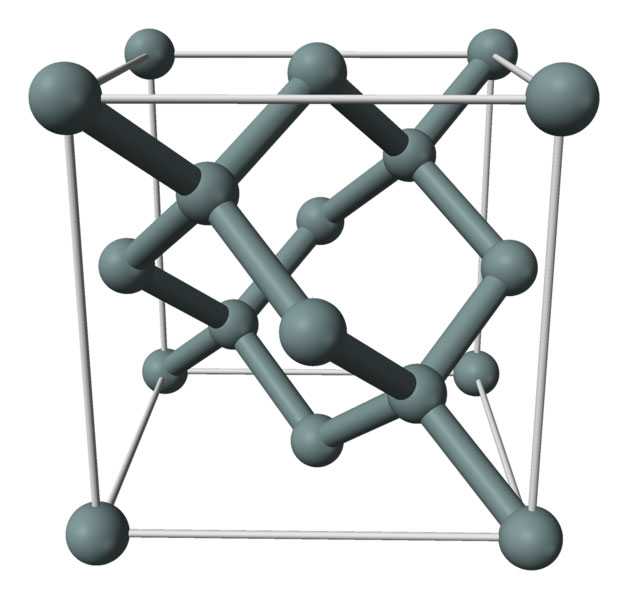 Кристаллическая структура кремния
Кристаллическая структура кремния
| Свойства атома | |
|---|---|
| Название, символ, номер | Кремний/Silicium (Si), 14 |
| Атомная масса (молярная масса) |
а. е. м. (г/моль) |
| Электронная конфигурация | 3s2 3p2; в соед. 3s 3p3 (гибридизация) |
| Радиус атома | 132 пм |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e), 271 (−4e) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | −4, 0, +2; +4 |
| Энергия ионизации (первый электрон) |
786,0 (8,15) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 2,33 г/см³ |
| Температура плавления | 1414,85 °C (1688 K) |
| Температура кипения | 2349,85 °C (2623 K) |
| Уд. теплота плавления | 50,6 кДж/моль |
| Уд. теплота испарения | 383 кДж/моль |
| Молярная теплоёмкость | 20,16 Дж/(K·моль) |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, алмазная |
| Параметры решётки | 5,4307 Å |
| Температура Дебая | 645 ± 5 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 149 Вт/(м·К) |
| Номер CAS | 7440-21-3 |
В ряде химических процессов кремний ведет себя как металл.
Аморфный кремний и углерод [ править ]
Аморфные сплавы кремния и углерода (аморфный карбид кремния , также гидрированный, a-Si 1 − x C x : H) представляют собой интересный вариант. Введение атомов углерода добавляет дополнительные степени свободы для управления свойствами материала. Пленку можно также сделать прозрачной для видимого света.
Увеличение концентрации углерода в сплаве увеличивает электронный зазор между зоной проводимости и валентной зоной (также называемый «оптическим зазором» и запрещенной зоной ). Это потенциально может повысить световую эффективность солнечных элементов, изготовленных из слоев аморфного карбида кремния. С другой стороны, на электронные свойства полупроводника (в основном подвижность электронов ) отрицательно влияет увеличение содержания углерода в сплаве из-за повышенного беспорядка в атомной сети.
В научной литературе можно найти несколько исследований, в основном изучающих влияние параметров осаждения на качество электроники, но практическое применение аморфного карбида кремния в промышленных устройствах все еще отсутствует.
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
ПРИМЕНЕНИЕ
 Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики, используется для изготовления зеркал газовых лазеров.
Соединения металлов с кремнием — силициды — являются широко употребляемыми в промышленности (например, электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.). Силициды ряда элементов являются важными термоэлектрическими материалами.
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них. Широко известен силикатный клей, применяемый в строительстве как сиккатив, а в пиротехнике и в быту для склеивания бумаги. Получили широкое распространение силиконовые масла и силиконы — материалы на основе кремнийорганических соединений.
Технический кремний находит следующие применения:
- сырьё для металлургических производств: компонент сплава (бронзы, силумин);
- раскислитель (при выплавке чугуна и сталей);
- модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей уменьшает коэрцитивную силу готового продукта) и т. п.;
- сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния (в литературе «umg-Si»);
- сырьё для производства кремний органических материалов, силанов;
- иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях;
- для производства солнечных батарей;
- антиблок (антиадгезивная добавка) в промышленности пластмасс.
Кремний (англ. Silicon) – Si
| Молекулярный вес | 28.09 г/моль |
| Происхождение названия | в переводе c др.-греч. κρημνός — «утёс, гора». |
| IMA статус | действителен |
Распространение в природе, пути получения, использование
Диоксид кремния (химическая формула: SiO2, кремнезем) – это бесцветное кристаллическое, стеклообразное или аморфное вещество. Этот минерал в виде кварцевого песка широко применяют в строительстве, в производстве химической продукции и радиотехники, в авиационном строительстве и многих других отраслях.
Распространение кремнезема в природе
Диоксид кремния содержится в земной коре в виде смесей с некоторыми другими минералами (их называют граниты) и в виде силикатов, входит в состав горных пород. Наиболее распространенный в природе минерал – кварц, намного реже встречаются кристобалит, халцедоны, тридимит, опалы, лешательерит (кварцевое стекло). Мелкие кристаллы кварца образуют так называемый «жильный» кварц. При постепенном разрушении горных пород образуются кварцевые пески, которые, уплотняясь, приводят к появлению кварцитов и песчаников.
Горный хрусталь – это наиболее чистый кварц, бесцветный. Его кристаллы могут весить десятки тонн и достигать длины в несколько метров. Также кварц может быть окрашен различными примесями в фиолетовый цвет (аметист), желтый (цитрин), черный (морион), дымчатый (раухтопаз). В природе встречаются и скрытокристаллические формы кварца: это красно-розовый сердолик, зелено-яблочный хризопраз, синеватый сапфир, тонко-окрашенная яшма, ониксы и агаты песчаные, роговики и кремни.
Уникален «благородный» опал, который состоит из коллоидных однородных частиц диаметром примерно 0,2 мкм. Эти частицы плотно упакованы в упорядоченные агломераты, воды в них содержится менее одного процента (в большинстве опалов – около семи процентов). Природные месторождения диоксида кремния могут также образовывать диатомит, трепел. Из этого минерала построены панцири диатомовых водорослей, скелеты некоторых губок. Он входит в состав стеблей растений – таких, как тростник, хвощ, бамбук.
Как получают диоксид кремния?
Синтетический SiO2 можно получить:
- – путем воздействия соляной (HCl) или серной (H2SO4) кислот на силикат натрия, реже – на другие растворимые силикаты (этот способ является основным в развитых странах);
- – используя кремния диоксид коллоидный (путем его замораживания или коагуляции под действием ионов F-, Na+);
- — путем гидролиза фтористого кремния SiF4, четыреххлористого кремния SiCl4, тетраэтоксисилана (C2H5O)4Si, твердого десублимата (NH4)2SiF6 в газовой форме, а также в водно-аммиачных и водных растворах (иногда с добавлением органических оснований или этанола).
Диоксид кремния аморфный получают:
- – из диатомита и трепела;
- – прокаливанием рисовой шелухи;
- – размалыванием плавленого кварцевого песка.
Безводные порошки кремнезема получают:
- – используя химическое осаждение из газовой фазы;
- – путем гидролиза и окисления паров сложных эфиров пирогенного кремнезема и фтористого кремния;
- — путем сжигания паров четыреххлористого кремния SiCl4 в смеси О2 и Н2.
Как используют диоксид кремния?
- – кремнезем природный используют в производстве изделий из фарфора, бетона, абразивов, кирпича силикатного, керамики, фаянса, динаса, силикатных стекол;
- – кремнезем синтетический («сажу белую») используют в качестве наполнителя в производстве резин;
- – монокристаллы кварца нашли применение в радиотехнике (фильтры, стабилизаторы частоты пьезоэлектрические, резонаторы), в акустоэлектронике и акустооптике, в ювелирном деле, в оптическом приборостроении;
- – горный хрусталь и синтетический диоксид кремния используются как сырье для производства кварцевого стекла, монокристаллов кварца, кварцевых волокон и керамики. В свою очередь, керамику и кварцевое стекло применяют в авиационной промышленности, оптике, электронике и других отраслях. Кварцевую ткань используют как материал, удерживающий тепло, а кварцевые волокна – для создания волоконно-оптических систем передачи информации и линий связи.
Аморфный кремний и углерод
Аморфный сплавы кремния и углерода (аморфный кремний карбид, также гидрированный, a-Si1-хCИкс: H) — интересный вариант. Введение атомов углерода добавляет дополнительные степени свободы для управления свойствами материала. Фильм тоже можно было снять прозрачный до видимого света.
Увеличение концентрации углерода в сплаве увеличивает электронный зазор между зоной проводимости и валентной зоной (также называемый «оптическим зазором» и запрещенная зона ). Это потенциально может повысить световую эффективность солнечных элементов, изготовленных из слоев аморфного карбида кремния. С другой стороны, электронные свойства как полупроводник (в основном подвижность электронов ), отрицательно сказываются на увеличении содержания углерода в сплаве из-за увеличения беспорядка в атомной сетке.
В научной литературе можно найти несколько исследований, в основном изучающих влияние параметров осаждения на качество электроники, но практическое применение аморфного карбида кремния в промышленных устройствах все еще отсутствует.
Ковалентный характер
Этот ковалентный характер обусловлен тем, что, как и углерод, кремний имеет четыре валентных электрона в соответствии с его электронной конфигурацией:
3 с2 3p2
Для связывания чистые 3s и 2p орбитали бесполезны. Вот почему атом создает четыре гибридных sp-орбитали3, с помощью которых он может образовывать четыре ковалентные связи Si-Si и, таким образом, заполнять октет валентности для двух атомов кремния.
Затем кристалл кремния визуализируется как трехмерная ковалентная решетка, состоящая из связанных тетраэдров.
Однако эта сетка не идеальна, поскольку в ней есть дефекты и границы зерен, которые отделяют один кристалл от другого и определяют их; а когда таких кристаллов очень мало и их много, мы говорим о поликристаллическом твердом теле, идентифицируемом по его неоднородному блеску (подобному серебряной мозаике или чешуйчатой поверхности).
Технология получения
Цель переработки сырья – максимально чистое вещество.
В лабораториях процедура следующая:
- Добывают силицид магния.
- Воздействуют на вещество уксусной либо соляной кислотой.
- Образовавшийся моносилан очищают (сорбентами, ректификаторами), нагревают до 1050°C.
В результате получают водород и кремний.
Для промышленников сырьем служит белый песок мелких фракций (диоксид вещества с формулой SiO2).

Кристалл кремния
Способ получения неметалла предусматривает следующие этапы:
- Прокаливание смеси сырья с магнием до образования аморфной модификации. Продукт выглядит как буроватый порошок.
- Технически чистый материал (99,9%) получают в печи при 1780°C. Из расплава диоксида вещество восстанавливают коксом.
- При необходимости изымают углерод, другие примеси.
Очищают кремний прямым хлорированием. Из полученных соединений изымают примеси, восстанавливают водородом при 910-1150°C.
Монокристалл кремния, выращенный по методу Чохральского
Новые технологии очистки предусматривают замену хлора фтором: это экологичнее и рентабельнее. Есть способы получения вещества на основе дистилляции оксида неметалла, вытравкой примесей.
Кремний, как простое вещество
Кремний представляет из себя темно-серое кристаллическое вещество с металлическим блеском. Кристаллический кремний является полупроводником.
Кремний образует только одну аллотропную модификацию, подобную алмазу, но при этом не такую прочную, т. к. связи Si-Si не так прочны, как в алмазной молекуле углерода (См. ).
Аморфный кремний — порошок бурого цвета, с температурой плавления 1420°C.
Кристаллический кремний получают из аморфного путем его перекристаллизации. В отличие от аморфного кремния, который является достаточно активным химическим веществом, кристаллический кремний более инертен в плане взаимодействия с другими веществами.
Строение кристаллической решетки кремния повторяет структуру алмаза, — каждый атом окружен четырьмя другими атомами, расположенными в вершинах тетраэдра. Атомы связываются друг с другом ковалентными связями, которые не так прочны, как углеродные связи в алмазе. По этой причине, даже при н.у. некоторые ковалентные связи в кристаллическом кремнии разрушаются, в результате чего высвобождается некоторая часть электронов, благодаря чему кремний обладает небольшой электропроводностью. По мере нагревания кремния, на свету или при добавлении некоторых примесей, кол-во разрушаемых ковалентных связей увеличивается, вследствие чего и увеличивается кол-во свободных электронов, следовательно, растет и электропроводность кремния.
Применение

Области применения кремния трудно перечислить:
- стекла;
- цемент;
- зажигалки;
- оптоволокно;
- керамика;
- микропроцессоры.
В любой зубной пасте есть Е551 — аморфный диоксид кремния.
На основе кремниевых полупроводников устроены почти все электронные приборы.
Большинство наших домов на 20-40%% состоят из кремниевых минералов.
Нитриты и карбиды кремния — одни из самых твердых соединений. Они входят в состав особой жаропрочной и твердой керамики. Ее используют в производстве бронежилетов, абразивы (абразивные диски для всем известных болгарок). Рекомендуем: ТАНТАЛ — твёрдый, редкий и дорогой
Как сырье технической чистоты Silicium применяют:
- В металлургии (как присадки, как раскислители в производстве чугуна и сталей).
- В производстве силанов и кремнийорганических материалов.
- В производстве солнечных батарей.
Синтетические SiC под названием муассанита с успехом заменяют алмазы в ювелирной промышленности.
Продукцией из песка, соды и извести стеклом — пользуются миллионы людей.
Красота и здоровье: полуметалл необходим человеческому организму для костей, волос, здоровой кожи. А силикон — материал, с помощью которого женщины исправляют свои формы.
Процессы осаждения [ править ]
| ССЗ | PECVD | Каталитический CVD | Распыление | |
|---|---|---|---|---|
| Тип фильма | a-Si: H | a-Si: H | a-Si: H | как и я |
| Уникальное приложение | Электроника большой площади | Безводородное осаждение | ||
| Температура камеры | 600C | 30–300 ° C | 30–1000 ° C | |
| Температура активного элемента | 2000C | |||
| Давление в камере | 0,1–10 торр | 0,1–10 торр | 0,001–0,1 торр | |
| Физический принцип | Термолиз | Плазма-индуцированная диссоциация | Термолиз | Ионизация источника Si |
| Фасилитаторы | W / Ta нагревательные провода | Катионы аргона | ||
| Типичное напряжение привода | RF 13,56 МГц; 0,01-1 Вт / см 2 | |||
| Источник Si | SiH 4 газ | SiH 4 газ | SiH 4 газ | Цель |
| Температура основания | управляемый | управляемый | управляемый | управляемый |
Плюсы и минусы
Кремний наделен свойствами, полезными либо нет с утилитарной точки зрения.
Недостатки вещества:
- Энергозатратность при получении чистого материала.
- Хрупкость. Но при нагреве выше 810°С кремний обретает пластичность.
Достоинства материала:
- Доступность сырья: четверть земной коры – это кремний.
- Простота технологии извлечения вещества.
- Способность образовывать линейку соединений: диоксид, силаны, силициды, силикаты. Плюс твердые конгломераты – база для создания сотен видов стекла, керамики.
- Возможности как полупроводника широкого охвата. На электрические характеристики неметалла влияют примеси. Промышленность «эксплуатирует» этот феномен для создания полупроводников заданного типа.
Главный плюс кремния – нулевая токсичность. Она облегчает использование неметалла всеми сегментами рынка, включая медицину и фармакологию.
Гидрированный аморфный кремний
Негидрированный a-Si имеет очень высокую плотность дефектов, что приводит к нежелательным свойствам полупроводника, таким как плохая фотопроводимость, и предотвращает легирование, которое имеет решающее значение для инженерных свойств полупроводников. Вводя водород во время производства аморфного кремния, фотопроводимость значительно улучшается и становится возможным допирование. Гидрированный аморфный кремний a-Si: H был впервые изготовлен в 1969 году Читтиком, Александром и Стерлингом путем осаждения с использованием предшественника газообразного силана (SiH4). Полученный материал показал более низкую плотность дефектов и повышенную проводимость из-за примесей. Интерес к a-Si: H возник, когда (в 1975 г.) LeComber и Копье обнаружил способность замещающего легирования a-Si: H с использованием фосфина (n-тип) или диборана (p-тип). Роль водорода в восстановлении дефектов была подтверждена группой Пола в Гарварде, которая обнаружила концентрацию водорода около 10 атомных% через ИК-колебание, которое для связей Si-H имеет частоту около 2000 см−1. Начиная с 1970-х годов RCA разработала a-Si: H в солнечных элементах, благодаря чему в 2015 году его эффективность неуклонно повышалась до примерно 13,6%.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Химические свойства кремния
Как и углерод, кремний может быть и восстановителем, и окислителем, в зависимости от того, с каким веществом вступает в реакцию.
При н.у. кремний взаимодействует только с фтором, что объясняется достаточно прочной кристаллической решеткой кремния.
В реакцию с хлором и бромом кремний вступает при температурах, превышающих 400°C.
С углеродом и азотом кремний взаимодействует только при очень высоких температурах.
- В реакциях с неметаллами кремний выступает в роли восстановителя:
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
Si + 2F2 = SiF4 - при высоких температурах кремний реагирует с хлором (400°C), кислородом (600°C), азотом (1000°C), углеродом (2000°C):
- Si + 2Cl2 = SiCl4 — галогенид кремния;
- Si + O2 = SiO2 — оксид кремния;
- 3Si + 2N2 = Si3N4 — нитрид кремния;
- Si + C = SiC — карборунд (карбид кремния)
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
- В реакциях с металлами кремний является окислителем (образуются салициды:Si + 2Mg = Mg2Si
- В реакциях с концентрированными р-рами щелочей кремний реагирует с выделением водорода, образуя растворимые соли кремниевой кислоты, называемые силикатами: Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
- С кислотами (за исключением HF) кремний не реагирует.
Биологическое воздействие
Как и в литосфере, в организме человека кремний – один из топовых макроэлементов (до 4%).
О нехватке вещества сигнализирует следующие факторы:
- Тусклость, ломкость волос, ногтей.
- Сухость кожи.
- Частые ОРВИ, ОРЗ.
- Учащенное сердцебиение.
- Ослабленность скелета (позвоночные боли, остеопороз).
- Бесплодие.
Плюс пониженный иммунитет. У детей – замедление роста и общего развития.
Пополнить запас микроэлемента помогают продукты.
Больше всего вещества в продуктах, богатых клетчаткой:
- Необработанные крупы: рис, овес, ячмень, гречка.
- Все бобовые.
- Орехи, овощи, ягоды, фрукты,
В «животном» сегменте это мясо, яйца, морепродукты, молоко.
Физико-химические характеристики
Кремний – это неметалл, но выступает как восстановитель либо окислитель:
- Образует сплавы (силициды) с большинством металлов.
- В обычном микроклимате покрывается пленкой-оксидом, становясь инертным.
- Химическая активность почти нулевая, однако растет с ростом температуры.
- Физические и химические свойства формируются строением кристаллической решетки (аллотропным форматом). Например, аморфный неметалл активно впитывает влагу, быстрее взаимодействует при обычной температуре.
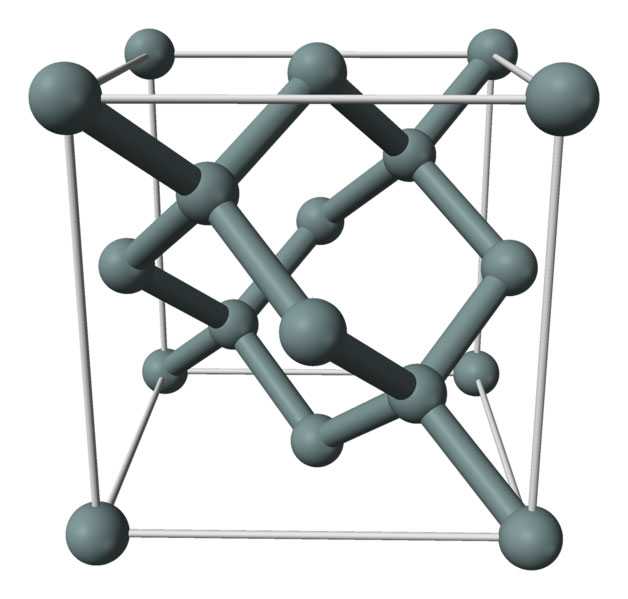
Кристаллическая структура кремния
| Свойства атома | |
| Название, символ, номер | Кремний/Silicium (Si), 14 |
| Атомная масса (молярная масса) | а. е. м. (г/моль) |
| Электронная конфигурация | 3s2 3p2; в соед. 3s 3p3 (гибридизация) |
| Радиус атома | 132 пм |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e), 271 (−4e) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | −4, 0, +2; +4 |
| Энергия ионизации (первый электрон) | 786,0 (8,15) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 2,33 г/см³ |
| Температура плавления | 1414,85 °C (1688 K) |
| Температура кипения | 2349,85 °C (2623 K) |
| Уд. теплота плавления | 50,6 кДж/моль |
| Уд. теплота испарения | 383 кДж/моль |
| Молярная теплоёмкость | 20,16 Дж/(K·моль) |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, алмазная |
| Параметры решётки | 5,4307 Å |
| Температура Дебая | 645 ± 5 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 149 Вт/(м·К) |
| Номер CAS | 7440-21-3 |
В ряде химических процессов кремний ведет себя как металл.
































